ВОДА, ЛІД І ПАР
- Історична довідка.
- Поширеність.
- Морська вода.
- Мінеральна вода.
- М'яка і жорстка вода.
- Молекулярна структура.
- ВОДА
- Тиск пару.
- Хімічні властивості.
- Гідрати.
- Гідроліз.
- Сольватація.
- Важка вода.
- ЛІД
- ПАР
ВОДА, ЛІД І ПАР, відповідно рідке, тверде й газоподібне стану хімічної сполуки молекулярної формули Н2О.
Історична довідка.
Ідея древніх філософів про те, що все в природі утворюють чотири елементи (стихії): земля, повітря, вогонь і вода, проіснувала аж до Середніх століть. У 1781 Г.Кавендиш повідомив про отримання ним води при спалюванні водню, але не оцінив повною мірою важливості свого відкриття. Пізніше (1783) А.Лавуазье довів, що вода зовсім не елемент, а з'єднання водню і кисню. Й. Берцеліусом і П.Дюлонг (1819), а також Ж.Дюма і Ж.Стас (1842) встановили ваговій склад води, пропускаючи водень через оксид міді, взятий в строго певній кількості, і зважуючи утворилися мідь і воду. Виходячи з цих даних, вони визначили ставлення Н: О для води. Крім того, в 1820-х роках Ж.Гей-Люссак виміряв обсяги газоподібних водню і кисню, які при взаємодії давали воду: вони співвідносилися між собою як 2: 1, що, як ми тепер знаємо, відповідає формулі Н2О.
Поширеність.
Вода покриває 3/4 поверхні Землі. Тіло людини складається з води приблизно на 70%, яйце - на 74%, а деякі овочі - це майже одна вода. Так, в кавуні її 92%, в стиглих томатах - 95%.
Вода в природних резервуарах ніколи не буває однорідною за складом: вона проходить через гірські породи, стикається з грунтом і повітрям, а тому містить розчинені гази і мінеральні речовини. Чистішою є дистильована вода.
Морська вода.
Склад морської води різниться в різних регіонах і залежить від припливу прісних вод, швидкості випаровування, кількості опадів, танення айсбергів і т.д. Див. Також ОКЕАН.
Мінеральна вода.
Мінеральна вода утворюється при просочуванні звичайної води крізь породи, що містять сполуки заліза, літію, сірки та інших елементів.
М'яка і жорстка вода.
Жорстка вода містить у великих кількостях солі кальцію і магнію. Вони розчиняються у воді при протіканні по породам, складеним гіпсом (СaSO4), вапняком (СаСО3) або доломітом (карбонати Mg і Са). У м'якій воді цих солей мало. Якщо вода містить сульфат кальцію, то кажуть, що вона має постійну (некарбонатних) жорсткістю. Її можна пом'якшити додаванням карбонату натрію; це призведе до осадження кальцію у вигляді карбонату, а в розчині залишиться сульфат натрію. Солі натрію не вступають в реакцію з милом, і витрата його буде менше, ніж в присутності солей кальцію і магнію.
Вода, що володіє тимчасової (карбонатної) жорсткістю, містить бікарбонати кальцію і магнію; її можна пом'якшити кількома способами: 1) нагріванням, що призводить до розкладання бікарбонатів на нерозчинні карбонати; 2) додаванням вапняної води (гідроксиду кальцію), в результаті чого бікарбонати перетворюються в нерозчинні карбонати; 3) за допомогою обмінних реакцій.
Вода, що містить у великій кількості розчинений діоксид вуглецю, просочуючись через вапнякові породи, розчиняє їх, що призводить до утворення печер. При підвищенні температури починається зворотний процес: бікарбонат розкладається і знову утворюється вапняк. Саме з нього складаються сталактити і сталагміти.
Молекулярна структура.
Аналіз даних, отриманих з спектрів поглинання, показав, що три атома в молекулі води утворюють трикутник з двома атомами водню в підставі і киснем в вершині:
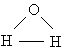
Валентний кут НОН дорівнює 104,31 °, довжина зв'язку О-Н становить 0,99 Å (1 Å = 10-8 см), а відстань Н-Н одно 1,515 Å. Атоми водню так глибоко «впроваджені» в атом кисню, що молекула виявляється майже сферичної; її радіус - 1,38 Å.
ВОДА
Фізичні властивості.
Завдяки сильному тяжінню між молекулами у води високі температури плавлення (0 ° С) і кипіння (100 ° С). Товстий шар води має блакитний колір, що обумовлюється не тільки її фізичними властивостями, а й присутністю зважених часток домішок. Вода гірських річок зеленувата через що містяться в ній зважених часток карбонату кальцію. Чиста вода - поганий провідник електрики, її питома електропровідність дорівнює 1,5 Ч 10-8 Ом-1 Ч см-1 при 0 ° С. Стисливість води дуже мала: 43 Ч 10-6 см3 на мегабар при 20 ° С. Щільність води максимальна при 4 ° С; це пояснюється властивостями водневих зв'язків її молекул.
Тиск пару.
Якщо залишити воду у відкритій ємності, то вона поступово випарується - все її молекули перейдуть в повітря. У той же час вода, що знаходиться в щільно закупореній посудині, випаровується лише частково, тобто при певному тиску водяної пари між водою і повітрям, що знаходиться над нею, встановлюється рівновага. Тиск пари в рівновазі залежить від температури і називається тиском насиченої пари (або його пружністю). Коли тиск насиченої пари порівнюється із зовнішнім тиском, вода закипає. При звичайному тиску 760 мм рт.ст. вода кипить при 100 ° С, а на висоті 2900 м над рівнем моря атмосферний тиск падає до 525 мм рт.ст. і температура кипіння виявляється рівною 90 ° С.
Випаровування відбувається навіть з поверхні снігу і льоду, саме тому висихає на морозі мокру білизну.
В'язкість води з ростом температури швидко зменшується і при 100 ° С виявляється в 8 разів менше, ніж при 0 ° С.
Хімічні властивості.
Каталітична дія.
Дуже багато хімічних реакцій протікають тільки в присутності води. Так, окислення киснем не відбувається в сухих газах, метали не реагують з хлором і т.д.
Гідрати.
Багато з'єднання завжди містять певну кількість молекул води і називаються тому гідратами. Природа утворюються при цьому зв'язків може бути різною. Наприклад, в пентагідрат сульфату міді, або мідному купоросу CuSO4 Ч 5H2O, чотири молекули води утворюють координаційні зв'язки з іоном сульфату, що руйнуються при 125 ° С; п'ята ж молекула води пов'язана так міцно, що відривається лише при температурі 250 ° С. Ще один стабільний гідрат - сірчана кислота; вона існує в двох гідратних формах, SO3 Ч H2O і SO2 (OH) 2, між якими встановлюється рівновага. Іони в водних розчинах теж часто бувають гідратованих. Так, Н + завжди знаходиться у вигляді іона гідроксонію Н3О + або Н5О2 +; іон літію - у вигляді Li (H2O) 6 + і т.д. Елементи як такі рідко перебувають у гидратированной формі. Виняток становлять бром і хлор, які утворюють гідрати Br2 Ч 10 H2O і Cl2 Ч 6H2О. Деякі звичайні гідрати містять кристалізаційну воду, наприклад хлорид барію BaCl2 Ч 2H2O, англійська сіль (сульфат магнію) MgSO4 Ч 7H2O, питна сода (карбонат натрію) Na2CO3 Ч 10 H2O, глауберової сіль (сульфат натрію) Na2SO4 Ч 10 H2O. Солі можуть утворювати кілька гідратів; так, сульфат міді існує у вигляді CuSO4 Ч 5H2O, CuSO4 Ч 3H2O і CuSO4 Ч H2O. Якщо тиск насиченої пари гідрату більше, ніж атмосферний тиск, то сіль буде втрачати воду. Цей процес називається вицвітанням (вивітрюванням). Процес, при якому сіль поглинає воду, називається распливанія.
Гідроліз.
Гідроліз - це реакція подвійного розкладання, в якій одним з реагентів є вода; трихлорид фосфору PCl3 легко вступає в реакцію з водою:
PCl3 + 3H2O = P (OH) 3 + 3HCl
Аналогічним чином гідролізуються жири з утворенням жирних кислот і гліцерину.
Сольватація.
Вода - полярне з'єднання, а тому охоче вступає в електростатичне взаємодія з частками (іонами або молекулами) розчинених в ній речовин. Утворилися в результаті сольватації молекулярні групи називаються сольватамі. Шар молекул води, пов'язаний з центральною часткою сольвату силами тяжіння, становить сольватную оболонку. Вперше поняття сольватації було введено в 1891 І.А.Каблуковим.
Важка вода.
У 1931 Г. Юри показав, що при випаровуванні рідкого водню його останні фракції виявляються важче звичайного водню внаслідок вмісту в них в два рази більше важкого ізотопу. Цей ізотоп називається дейтерієм і позначається символом D. За своїми властивостями вода, що містить замість звичайного водню його важкий ізотоп, істотно відрізняється від звичайної води.
У природі на кожні 5000 масових частин Н2О доводиться одна частина D2O. Це співвідношення однакове для річковий, дощової, болотної води, підземних вод або кристалізаційної води. Важка вода використовується в якості мітки при дослідженні фізіологічних процесів. Так, в сечі людини співвідношення між Н і D теж дорівнює 5000: 1. Якщо дати пацієнту випити воду з великим вмістом D2O, то, послідовно вимірюючи частку цієї води в сечі, можна визначити швидкість виведення води з організму. Виявилося, що близько половини випитої води залишається в організмі навіть через 15 діб. Важка вода, вірніше, що входить до її складу дейтерій - важливий учасник реакцій ядерного синтезу.
Третій ізотоп водню - тритій, що позначається символом Т. На відміну від перших двох він радіоактивний і виявлений в природі лише в малих кількостях. У прісноводних озерах співвідношення між ним і звичайним воднем дорівнює 1: 1018, в поверхневих водах - 1: 1019 в глибинних водах він відсутній. Див. Також ВОДЕНЬ.
ЛІД
Лід, тверда фаза води, використовується в основному як холодоагент. Він може знаходитися в рівновазі з рідкою і газоподібною фазами або тільки з газоподібної фазою. Товстий шар льоду має блакитний колір, що пов'язано з особливостями заломлення їм світла. Стисливість льоду дуже низька.
Лід при нормальному тиску існує тільки при температурі 0 ° С або нижче і має меншу щільність, ніж холодна вода. Саме тому айсберги плавають у воді. При цьому, оскільки відношення щільності льоду і води при 0 ° С постійно, лід завжди виступає з води на певну частину, а саме на 1/5 свого об'єму. Див. Також айсберга.
ПАР
Пар - газоподібна фаза води. Всупереч загальноприйнятій думці, він невидимий. Той «пар», який виривається з киплячого чайника, - це насправді безліч дрібних крапельок води. Пар має властивості, дуже важливими для підтримки життя на Землі. Добре відомо, наприклад, що під дією сонячного тепла вода з поверхні морів і океанів випаровується. Утворені водяні пари піднімаються в атмосферу і конденсуються, а потім випадають на землю у вигляді дощу і снігу. Без такого кругообігу води наша планета давно перетворилася б в пустелю.
Пар має безліч застосувань. З одними ми добре знайомі, про інші лише чули. Серед найбільш відомих пристроїв і механізмів, що працюють із застосуванням пара, - праски, паровози, пароплави, парові котли. Пар обертає турбіни генераторів на теплових електростанціях. Див. Також КОТЕЛ ПАРОВОЇ; ДВИГУН ТЕПЛОВОЇ; ТЕПЛОТА; ТЕРМОДИНАМІКА.